1. VOLAILLE ET FOIE GRAS
C’est fait comment ?
En faisant proliférer des cellules de poulet, de dinde ou de canard dans des nutriments, comme un mélange de sels, de glucides, de protéines et de facteurs de croissance, pour produire du tissu musculaire ou, plus facilement, du foie gras.
C’est pour quand ?
1. D’ici à la fin de l’année, promet la société californienne Just for All, qui a fait fortune en commercialisant une mayonnaise végétalienne.
2. Vers 2021, espère la start-up californienne Memphis Meat, qui a cultivé la toute première boulette de viande in vitro.
3. « Dans un avenir très rapproché », affirme la start-up israélienne Super Meat, qui espérait initialement cultiver des poitrines entières.
4. Après 2019, dit la start-up israélienne Future Meat Technologies, qui veut distribuer des cellules et des milliers de petits bioréacteurs aux fermiers pour qu’ils se recyclent en agriculteurs cellulaires.
36 %
Proportion des intoxications alimentaires déclarées au Québec qui mettaient en cause de la volaille ; c’est le groupe le plus ciblé.
Source : Bilan annuel 2014-2015 – Toxi-infections alimentaires, ministère québécois de l’Agriculture, des Pêcheries et de l’Alimentation
« En continuant comme cardiologue, je sauverais peut-être 2000 ou 3000 personnes au cours des 30 prochaines années. Mais en me concentrant sur [la viande cultivée], j’ai la possibilité de sauver des milliards de vies humaines et animales. »
— Uma Valeti, PDG de Memphis Meat, dans un article du site Inc.com
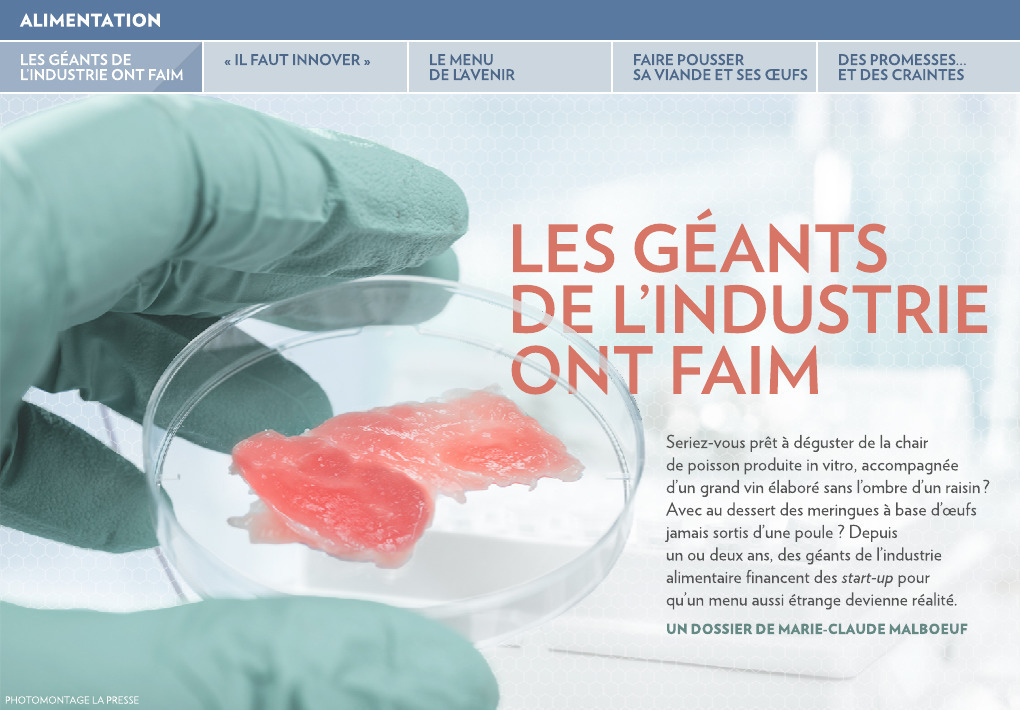
2. POISSON ET FRUITS DE MER
C’est fait comment ?
En cultivant des cellules de poisson, apparemment plus faciles à cultiver que les cellules de viande rouge, entre autres parce qu’elles prolifèrent à la température de la pièce, sans devoir être chauffées.
C’est pour quand ?
1. Au début de 2020, affirme la start-up californienne Finless Foods, qui compte commercialiser d’abord du thon rouge.
2. Une date non précisée, selon la start-up californienne Wild Type, qui veut produire du saumon à sushi épicé et du saumon fumé.
90 %
Proportion des réserves mondiales de poisson déjà exploitées au maximum de leur capacité ou surexploitées
Source : La situation mondiale des pêches et de l’aquaculture, Organisation des Nations unies pour l’alimentation et l’agriculture, 2016
1 million
Nombre de Canadiens qui tombent malades chaque année après avoir ingéré un aliment contaminé au norovirus, des fruits de mer dans le tiers des cas .
Source : Agence de la santé publique du Canada
« L’aquaculture est un désastre environnemental. Elle suppose un usage massif de pesticides, d’herbicides et d’antibiotiques, qui détruisent des écosystèmes et contaminent les océans. »
— Michael Selden, PDG de Finless Foods, en entrevue à La Presse
3. VIANDE ROUGE
C’est fait comment ?
En cultivant des cellules de vache ou de porc, pour produire du tissu musculaire, du gras et, peut-être un jour, des tissus connectifs et des vaisseaux sanguins.
C’est pour quand ?
1. D’ici à 2021, espère la start-up néerlandaise Mosa Meat, qui compte produire des galettes de viande hachée et a été fondée par le créateur du tout premier – et très célèbre – hamburger in vitro.
2. La même année, promet la start-up israélienne Aleph Farm, qui affirme mettre au point une nouvelle méthode permettant de cultiver des cellules irriguées par des vaisseaux sanguins, afin de produire des steaks entiers.
3. D’ici à 2030, estime la start-up japonaise Integriculture, qui a déjà cultivé des foies, des pancréas, des muscles et des intestins de poulet. Son PDG a d’abord formé un groupe de scientifiques amateurs (Shojinmeat Project) qui cultivent déjà de la viande à domicile et distribuent les instruments requis dans des écoles secondaires !
18 %
Proportion des gaz à effet de serre produits par le bétail de la planète, soit plus qu’en produit la totalité des camions, voitures et avions en circulation
Source : L’ombre portée de l’élevage, Organisation des Nations unies pour l’alimentation et l’agriculture, 2006
12 800
Nombre de Canadiens qui tombent malades chaque année après avoir ingéré un aliment contaminé à l’E. coli, du bœuf dans environ la moitié des cas
Source : Agence de la santé publique du Canada
« Nous nous concentrons sur le bœuf, car c’est sa production qui est la moins efficace. Vous devez donner 1 kg de nourriture aux bovins pour obtenir 150 g de muscle. »
— Peter Verstrate, PDG de Mosa Meat, dans un courriel envoyé à La Presse
4. PRODUITS LAITIERS
C’est fait comment ?
Comme pour la bière, avec de la levure nourrie de sucre. Mais on la reprogramme en insérant dans son génome l’ADN responsable, chez la vache, de la fabrication de la caséine et des protéines du petit lait.
C’est pour quand ?
Une date non précisée par la start-up californienne Perfect Day, qui a breveté sa méthode cette année et obtenu 25 millions de dollars de divers fonds d’investissement.
3400 L
Quantité d’eau requise pour produire seulement quatre litres de lait de vache, l’équivalent d’une piscine olympique
Source : Clean Meat, 2018
« Nous avons parlé à tellement de marques qui souhaitent travailler avec les ingrédients que nous développons […], nous pourrions avoir un impact sur chaque rayon de l’épicerie, pas seulement sur les produits laitiers frais. »
— Ryan Pandya, PDG de Perfect Day, en 2017, dans un article de Food Navigator – USA
5. BLANCS D’ŒUF
C’est fait comment ?
Comme pour le lait, au moyen d’une levure génétiquement modifiée et « reprogrammée » afin de fabriquer les 12 protéines des blancs d’œuf.
C’est pour quand ?
2019, a annoncé la start-up californienne Clara Foods
190 L
Quantité d’eau requise pour produire chaque œuf, l’équivalent d’une baignoire
Source : Clean Meat, 2018
« Aux États-Unis, il y a plus de poulets que de gens, chacun est confiné à la surface d’un morceau de papier et ne voit jamais la lumière du jour. »
— Arturo Elizondo, fondateur de Clara Foods, au quotidien The Guardian
6. GÉLATINE
C’est fait comment ?
En insérant, dans des bactéries, l’ADN responsable de la production de collagène chez certains animaux. Normalement extraite des os ou de la peau – qu’il faut plonger dans l’acide pendant des semaines –, cette protéine sert à fabriquer de la guimauve, des bonbons, des gelées, etc.
C’est pour quand ?
Pour 2023, espère la start-up californienne Geltor. Elle vend déjà à l’industrie cosmétique un produit similaire, qui a reçu un prix d’innovation en mai.
80 %
Proportion des antibiotiques vendus ou distribués aux États-Unis qui sont destinés au bétail, un usage qui contribue à rendre les bactéries de plus en plus résistantes et dangereuses pour les humains
Source : Drug Use Review, Food and Drug Administration, 2012
« Avant d’étudier en médecine, je rêvais d’ouvrir un hôpital où il n’y aurait pas de propagation d’infections. C’est entre autres ce qui m’a amené à m’intéresser au problème des bactéries résistantes aux antibiotiques. »
— Alexander Lorestani, PDG de Geltor, diplômé en médecine et en biologie moléculaire, en entrevue à La Presse
7. VIN
C’est fait comment ?
En recréant des vins coûteux, molécule par molécule, sans raisin ni fermentation. Les composés chimiques sont découverts en laboratoire, achetés de distributeurs, puis mélangés en respectant leurs concentrations respectives dans le vin à reproduire. Le tout est ensuite dilué dans de l’eau, de l’éthanol, du sucre et des acides aminés.
C’est pour quand ?
« Bientôt », a écrit à La Presse la start-up californienne Ava Winery, qui visait originellement la fin de 2017. Elle a d’abord produit un simple Moscato d’Asti, moyennement bien reçu par des goûteurs, et tente maintenant d’imiter un cabernet valant 100 $.
- 8 %
Chute de la production mondiale de vin en 2016, qui a ainsi atteint son pire creux en 56 ans, en raison de la multiplication d’événements climatiques extrêmes
Source : Organisation mondiale de la vigne et du vin, 2017
« De la même manière que les ordinateurs ont démocratisé l’art, nous espérons pouvoir démocratiser des vins de qualité pour que les masses puissent en profiter. »
— Alec Lee, PDG d’Ava Winery, dans un article du site Digital Trends
8. ÉPICES ET ÉDULCORANTS
C’est fait comment ?
En modifiant génétiquement de la levure pour la forcer à produire de la vanilline – une épice rare et coûteuse – ou pour qu’elle fabrique les molécules les plus sucrées des plants de stévia – présentes en quantité trop infime dans les feuilles de cette plante.
C’est pour quand ?
La vanille « 2.0 » créée par l’entreprise suisse Evolva a fait son entrée sur le marché en 2014. Son stévia a suivi en mars dernier. Elle tente actuellement de produire du safran de la même façon.