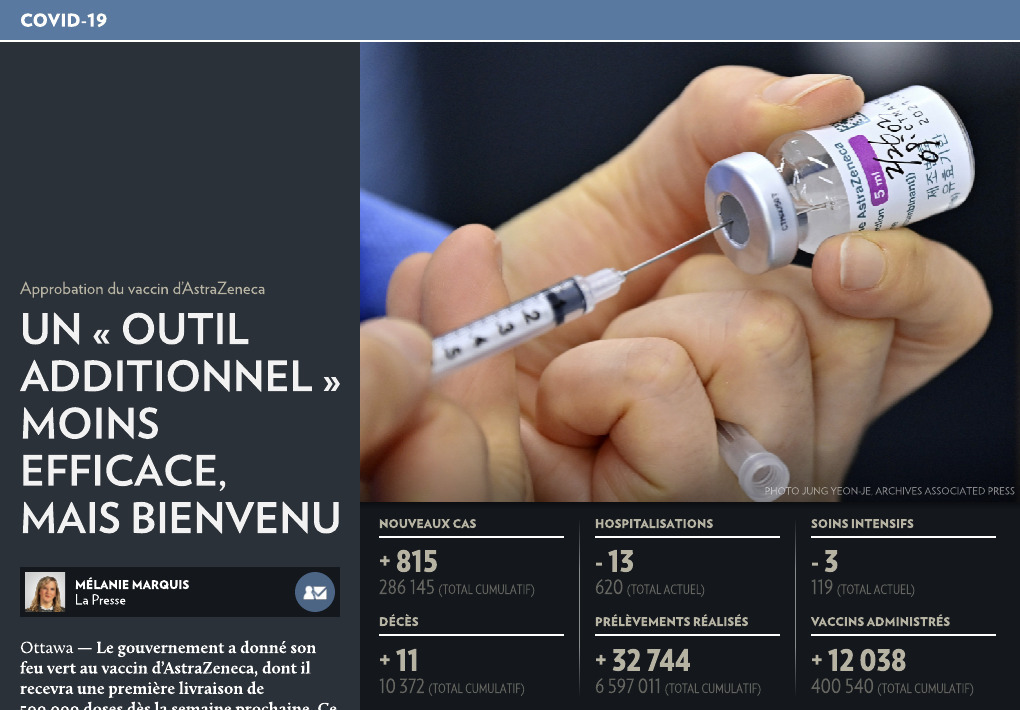
Un « outil additionnel » moins efficace, mais bienvenu
Ottawa — Le gouvernement a donné son feu vert au vaccin d’AstraZeneca, dont il recevra une première livraison de 500 000 doses dès la semaine prochaine. Ce vaccin moins efficace que les deux autres, et dont on ignore encore l’innocuité chez les personnes âgées de 65 ans et plus, s’avérera un « outil additionnel » dans la lutte contre la pandémie.
La décision de Santé Canada tombe près d’un mois après celle de l’Agence européenne des médicaments. À l’issue d’« examens approfondis et indépendants des données probantes », il a été conclu que « ces vaccins satisfont aux exigences rigoureuses du Canada en matière d’innocuité, d’efficacité et de qualité », a noté en conférence de presse le Dr Marc Berthiaume, directeur du Bureau des sciences médicales de Santé Canada.
L’efficacité du vaccin est évaluée à 62,1 % après deux doses, un taux nettement inférieur à celui des deux autres qui ont déjà été approuvés pour utilisation au Canada. À titre comparatif, les vaccins de Pfizer-BioNTech et de Moderna sont efficaces à 95 % et 94,1 %, respectivement. Mais à titre comparatif, toujours, le vaccin contre la grippe prévient le virus chez environ 40 % à 60 % des personnes en bonne santé, selon les souches.
Et d’après les autorités de santé publique, son apport à la campagne nationale d’immunisation collective sera précieux. Car cet « outil additionnel » dans la trousse vaccinale canadienne a démontré son efficacité pour la prévention des hospitalisations et des formes graves de la maladie ; aucune hospitalisation n’a été recensée dans les essais cliniques, a relevé le Dr Berthiaume.
À ses côtés, la Dre Supriya Sharma, conseillère médicale en chef de Santé Canada, a plaidé qu’il fallait éviter de diviser les vaccins en deux catégories, les « bons » et les « mauvais ». Car à partir du moment où la santé publique accorde son sceau d’approbation à un vaccin, c’est qu’il est efficace et sûr, a-t-elle dit, notant que la même logique s’applique pour la décision d’autoriser le vaccin pour les gens âgés de 65 ans et plus.
Dans certains pays, dont la France et l’Allemagne, les autorités sanitaires ont déconseillé d’injecter le vaccin d’AstraZeneca aux personnes âgées de plus de 65 ans.
Il n’est pas exclu que le Comité consultatif national de l’immunisation (CCNI), qui doit publier un avis la semaine prochaine, conseille de réserver le vaccin à une tranche d’âge inférieure, a noté la Dre Sharma.
Les échos européens auraient avantage à être entendus ici, d’après Roxane Borgès Da Silva, professeure à l’École de santé publique de l’Université de Montréal. « On nous dit qu’il faut se méfier », souligne-t-elle. Le plus important, néanmoins, sera de s’assurer de « rassurer la population », puisqu’« on ne veut pas que les gens commencent à dire qu’ils veulent juste le Pfizer ou le Moderna, et ça va être complètement fou ».
Des données préliminaires suggèrent par ailleurs que le vaccin d’AstraZeneca fonctionne contre le variant britannique, dans une proportion de 74,6 %, mais il serait peu efficace contre la forme sud-africaine du virus, d’après une étude menée en Afrique du Sud. L’OMS estime tout de même qu’il peut être administré dans les pays où les variants sont devenus dominants.
L’utilisation du vaccin d’AstraZeneca est autorisée pour les personnes de plus de 18 ans, et le délai prescrit entre l’administration de la première et de la seconde dose est de 4 à 12 semaines. Ce premier produit à base de vecteurs viraux contre la COVID-19 homologué au Canada sera plus facile à distribuer, car il peut être conservé à des températures comprises entre 2 °C et 8 °C durant au moins six mois.
Arrivée record de doses
Le gouvernement a conclu une entente pour mettre la main sur 20 millions de doses de ce vaccin conçu avec l’Université d’Oxford. Ces doses arriveront des États-Unis. Un autre accord prévoyant la livraison de 2 millions de doses a été finalisé jeudi avec le Serum Institute of India et la société pharmaceutique canadienne Verity – ce sont les doses qui seront envoyées en premier, à partir de l’Inde.
« Je peux confirmer qu’on va recevoir 500 000 doses […] dans les prochaines semaines. Le reste va arriver au printemps. »
— Justin Trudeau, premier ministre du Canada
La société Verity Pharmaceuticals a confirmé à La Presse que la première livraison aurait lieu la semaine prochaine. Arriveront ensuite 1 million de doses à la mi-avril, puis 500 000 début mai.
D’ici fin mars, on atteindra donc le cap des 6,5 millions de doses, et celui des 23 millions d’ici fin juin – ce nombre inclut 1,5 million de doses du vaccin d’AstraZeneca du Serum Institute of India, et 1,9 million de doses du même vaccin livrées via le programme COVAX, à partir de la Corée du Sud. Il ne comprend cependant pas les 20 millions de doses du vaccin d’AstraZeneca qui viendront du sud de la frontière, le calendrier demeurant à peaufiner.
Le verdict du gouvernement concernant le vaccin d’AstraZeneca tombe au terme d’une semaine où le Canada a reçu une quantité record de doses de vaccin, soit quelque 643 000. La cadence a tant augmenté qu’après une seule journée de prises de rendez-vous, on a élargi la campagne de vaccination à Montréal aux personnes de 80 ans et plus, au lieu de 85 ans et plus, comme il était prévu initialement.
Le ministre de la Santé et des Services sociaux du Québec, Christian Dubé, a qualifié l’approbation du vaccin d’« excellente nouvelle », disant attendre « les détails concernant les livraisons et le nombre de doses de la part du fédéral », dans un message publié sur Twitter vendredi.
Bilan québécois
Le Québec a enregistré vendredi 815 nouveaux cas de COVID-19 de même que 11 décès supplémentaires. Le nombre total de personnes infectées dans la province depuis le début de la pandémie s’élève maintenant à 286 145, dont 267 885 sont considérées comme rétablies.
Le bilan des décès est jusqu’ici de 10 372. On n’a répertorié aucun décès dans les dernières 24 heures. Quant au nombre total d’hospitalisations, il s’élève à 620, une diminution de 13. Parmi ces patients, 119 se trouvent aux soins intensifs, une baisse de 3.
— Avec Joël-Denis Bellavance et Ariane Lacoursière, La Presse, et La Presse Canadienne