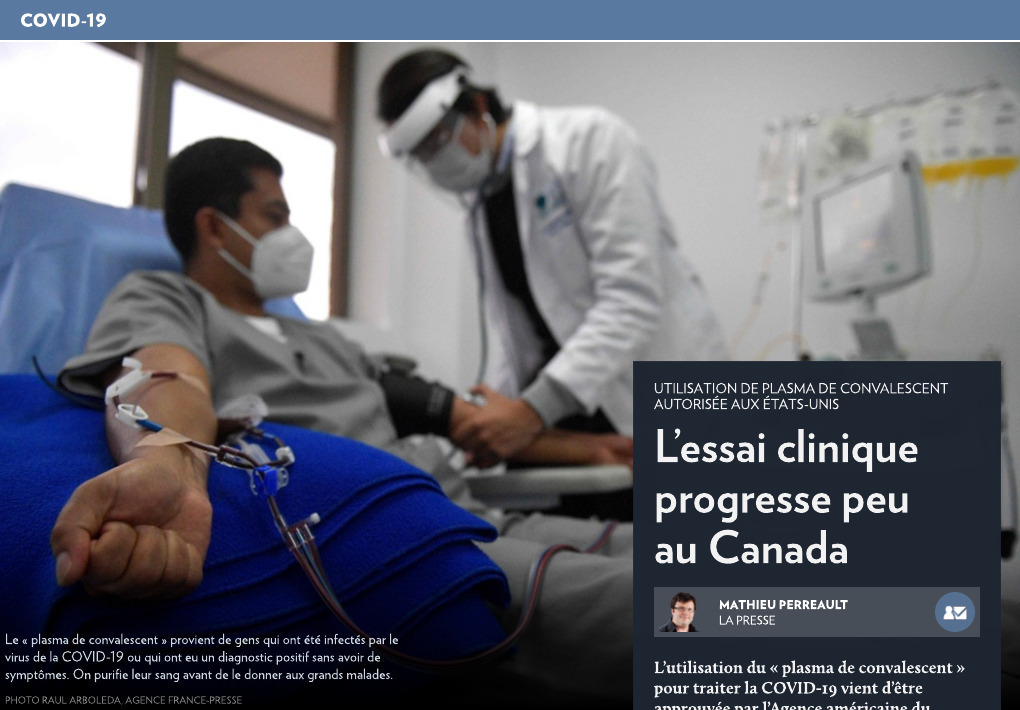
L’essai clinique progresse peu au Canada
L’utilisation du « plasma de convalescent » pour traiter la COVID-19 vient d’être approuvée par l’Agence américaine du médicament (FDA). L’essai clinique canadien, auquel participent des chercheurs montréalais, progresse de son côté à pas de tortue parce qu’il manque de patients.
« La FDA a dès le début demandé que l’utilisation de plasma de convalescent se fasse dans le cadre d’un essai clinique, mais il était possible d’avoir une autorisation d’exception assez facilement », explique l’immunologue Philippe Bégin du CHUM, qui est responsable de l’étude à Montréal. « C’est le principe du right to try [droit à l’essai]. Nous avons essayé de recruter aux États-Unis, à New York, au Texas, en Floride, en Californie, et on nous répondait que le traitement était déjà disponible. L’exception est devenue la règle. L’annonce de dimanche ne fait qu’enlever l’obligation de faire la demande d’exception en ligne. C’est un formulaire qui prenait deux minutes. »
Le grand avantage du plasma de convalescent est qu’il est peu probable qu’il ait des effets secondaires négatifs. Il s’agit de purifier le sang de gens qui ont été infectés par le virus de la COVID-19 et de le donner aux grands malades. Mais il s’agit d’une dépense inutile si le traitement ne fonctionne pas.
« Les résultats dévoilés par la FDA ne sont pas très convaincants, ils n’ont pas de groupe témoin, dit le Dr Bégin. Alors ils comparent les patients qui donnent du sang plus ou moins longtemps après leur guérison ou leur diagnostic. » Le type d’anticorps pouvant aider d’autres patients disparaît quelques semaines après la guérison.
L’essai clinique canadien, qui doit compter 1000 participants sur 49 sites, n’a recruté que 82 patients depuis avril. « On veut finaliser l’activation des sites pour la prochaine vague à l’automne », dit le Dr Bégin. Les participants ont deux chances sur trois de recevoir le plasma de convalescent plutôt qu’un placebo. En avril, le Dr Bégin espérait avoir des résultats en trois à dix mois.
Trump et la FDA
Jean-Pierre Routy, spécialiste du VIH à l’Université McGill qui participe à l’étude sur le plasma de convalescent, estime que l’étude canadienne a été trop tatillonne. « J’avais un outil tout prêt, nous faisons ce type de traitement quatre ou cinq fois par mois pour des maladies auto-immunes, dit le Dr Routy. Mais Héma-Québec m’a dit : “Même si le premier ministre se présente chez vous avec la COVID, vous n’avez pas le droit d’utiliser votre machine pour donner du plasma.” Il a fallu passer trois types d’examens éthiques, de 3 à 4 heures chacun. Avec tout ça, on a commencé deux mois après les premières rencontres. Ça m’a beaucoup contrarié, on survit aux contrariétés. »
« Du côté positif, l’étude est très, très bien faite, admirable, avec un grand contrôle de la qualité. On va avoir de bons résultats, mais on les aura à un moment où il y aura peut-être d’autres traitements, et on ne pourra de toute façon pas traiter tout le monde avec ça, il n’y aura pas assez de plasma de convalescent. »
— Jean-Pierre Routy, de l’Université McGill
Aux États-Unis, l’administration Trump a lancé en juillet une campagne de publicité pour encourager les gens ayant guéri de la COVID-19 ou ayant eu un diagnostic positif, mais pas de symptômes, à donner du sang pour fabriquer du plasma convalescent. Quelques jours avant l’annonce de la FDA, le président avait déclaré que l’agence se traînait les pieds pour approuver le traitement, ce qui a mené certains observateurs à dénoncer une ingérence politique dans les activités de la FDA. Quand cette dernière a annoncé l’approbation du plasma de convalescent, M. Trump a déclaré qu’elle réduisait la mortalité de 35 %, « un chiffre énorme ».
Cette réduction de 35 % correspond à la mortalité chez les patients qui reçoivent du plasma de convalescent trois jours, comparé à quatre jours après le début de leurs symptômes, selon une étude de la clinique Mayo. Dans le premier cas, la mortalité était de 8,7 %, dans le deuxième cas, de 11,9 %.